Untersuchungen der Genstruktur, der Geschlechtshormondrüsen, der Genitalien oder der Hormonpegel von Transsexuellen haben, bis heute, keine Ergebnisse geliefert, die ihren Status erklären [1,2]. Immerhin beeinflussen in Versuchstieren dieselben Geschlechtshormone, die auch vor der Geburt die Morphologie der Genitalien von Versuchstieren beeinflußt, die Morphologie und Funktion des Gehirns in einer geschlechtsdimorphischen Weise [6,7]. Dies führte zu der Hypothese, daß die geschlechtliche Differenzierung des Gehirns von Transsexuellen nicht der Linie der Geschlechtsdifferenzierung des Körpers als Ganzem folgt. In den letzten wenigen Jahren sind beträchtliche anatomische Unterschiede in Bezug auf Geschlecht und geschlechtliche Ausrichtung im menschlichen Hypothalamus beobachtet worden (siehe [6] für eine Übersicht), aber bis jetzt wurden keine neuroanatomischen Untersuchungen in Bezug auf den Ausdruck von gegengeschlechtlicher Identität (Transsexualität) angestellt.
Wir studierten den Hypothalamus von sechs Mann-zu-Frau-Transsexuellen
(T1-T6); dieses Material ist über die letzten elf Jahre gesammelt
worden. Wir suchten nach einer Gehirnstruktur, die geschlechtsdimorphisch
ist, aber nicht von der sexuellen Ausrichtung [=vom Hingezogenfühlen
zu einem Geschlecht - Anm.d.Übers.] abhängig ist, da Mann-zu-Frau-Transsexuelle
mit Rücksicht auf ihr geschlechtliches Verhalten zu jedem Geschlecht
hin "ausgerichtet" sein können. Unsere früheren Beobachtungen
haben gezeigt, daß der nucleus paraventricularis (PVN), der Geschlechtsdimorphische
nucleus (SDN) und der nucleus suprachiasmaticus (SCN) diese Kriterien
[6] nicht erfüllten. Obwohl es kein akzeptiertes Tiermodell für
Geschlechtsidentitätsänderungen gibt, stellte sich der bed nucleus
of stria terminalis (BST) als ein geeigneter Kandidat dafür heraus,
untersucht zu werden, und zwar aus folgenden Gründen. Erstens ist
es bekannt, daß der BST eine essentielle Rolle im Geschlechtsverhalten
von Nagern spielt [3,4]. Nicht nur sind Östrogen- und Testosteronrezeptoren
im BST gefunden worden [8,9], es ist auch ein größeres Zentrum
für Aromatase im sich entwickelnden Rattenhirn [10]. Der BST in Ratten
erhält Projektionsbahnen hauptsächlich vom Mandelkern (amygdala)
und führt einen kräftigem Input in die
regio praeoptica hypothalami [11,12]. Auch sind reziproke Verbindungen
zwischen Hypothalamus, BST und amygdala in Tierversuchen gut dokumentiert
[13-15]. Desweiteren wurden geschlechtliche Unterschiede in der Größe
und Zellenanzahl im BST von Nagern, die während ihrer Entwicklung
mit Geschlechtshormonen beeinflußt worden waren, beschrieben [16-18].
Auch wurde berichtet, daß ein bestimmter caudaler Anteil des BST
(BNST-dspm) bei Männern zweieinhalb mal größer ist als
bei Frauen [19].
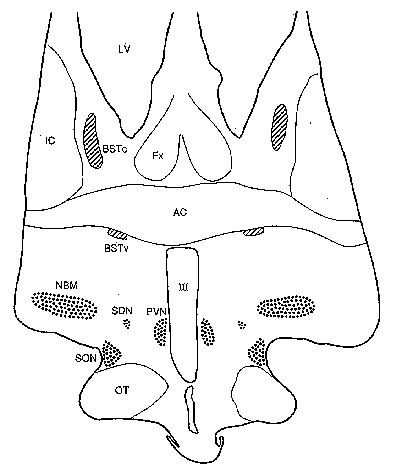 |
Der BST findet sich wie in Abb.1 gezeigt. Der zentrale Teil des BST (BSTc) ist durch seine Somatostatinzellen und seine VIP(vasoactive intestinal polypeptide)-Innervation charakterisiert [20]. Wir maßen die Größe des BSTc auf der Basis seiner VIP-Innervation (Abb.2)
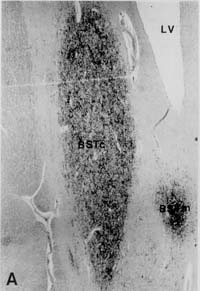 
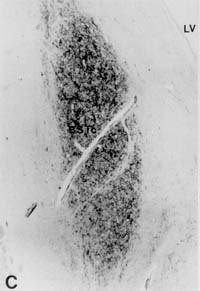 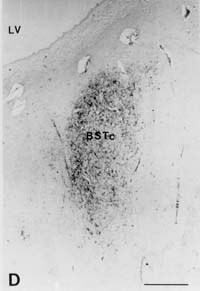 Representative Sektionen des
von vasoactive intestinal polypeptide (VIP) innervierten BSTc. A: Heterosexueller Mann; B: Heterosexuelle
Frau; C: Homosexueller Mann; D: Mann-zu-Frau-Transsexuelle. Balken = 0,5 mm LV: ventriculus lateralis
Beachten Sie, daß es bei A und B zwei Teile
des BST gibt : Die kleinere mediale Unterteilung (BSTm) und die
ovale größere Unterteilung (BSTc)
Representative Sektionen des
von vasoactive intestinal polypeptide (VIP) innervierten BSTc. A: Heterosexueller Mann; B: Heterosexuelle
Frau; C: Homosexueller Mann; D: Mann-zu-Frau-Transsexuelle. Balken = 0,5 mm LV: ventriculus lateralis
Beachten Sie, daß es bei A und B zwei Teile
des BST gibt : Die kleinere mediale Unterteilung (BSTm) und die
ovale größere Unterteilung (BSTc)
|
Der BSTc in heterosexuellen Männern (2,49±0.16 mm3) war um 44% größer als in heterosexuellen Frauen (1,73±0,13 mm3) (P<0,005) (Abb. 3). Die BSTc von heterosexuellen und homosexuellen Männern unterschieden sich statistisch nicht signifikant voneinander (2,81±0,20 mm3) (P=0,26). Der BSTc war bei homosexuellen Männern um 62% größer als bei heterosexuellen Frauen (P<0,005). AIDS schien nicht die Größe des BSTc zu beeinflussen : Die Größe des BSTc von zwei mit AIDS infizierten heterosexuellen Frauen und drei mit AIDS infizierten Männern blieb gut im Rahmen der entsprechenden Referenzgruppe. Daher wurden die AIDS-infizierten Heterosexuellen zu statistischen Zwecken in die entsprechende Referenzgruppe aufgenommen. Eine geringe Größe des BSTc (1,30±0,23 mm3) wurde bei Mann-zu-Frau-Transsexuellen gefunden (Abb. 3). Seine Größe entsprach nur 52% der in entsprechenden Männern gefundenen (P<0,005) und nur 46% des BSTc von homosexuellen Männern (P<0,005). Obwohl die Größe des BSTc von Transsexuellen sogar kleiner war als bei der Gruppe der Frauen, so erreichte der Unterschied doch keine statistische Signifikanz (P=0,13). Die Größe des BSTc stand in keiner der Referenzgruppen in Zusammenhang mit dem Alter, was anzeigte, daß die beobachtete geringe Größe des BSTc von Transsexuellen nicht auf das Alter zurückzuführen war, die in der Tat im Durchschnitt 10 bis 13 Jahre älter waren als die hetero- und homosexuellen Männer.
Der BST spielt eine essentielle Rolle im männlichen Geschlechtsverhalten und in der Regelung der Gonadotropinausschüttung, wie in Studien bei Ratten gezeigt wurde [3,4,21]. Es gab zwar keine direkte Offensichtlichkeit, daß der BST solch eine Rolle im menschlichen Geschlechtsverhalten spielt, aber unsere Demonstration eines geschlechtsdimorphischen Musters anhand der Größe des menschlichen BSTc, die im Einklang steht mit dem zuvor beschriebenen Geschlechtsunterschied in einem weiter caudal gelegenen Anteil des BST (BNST -dspm) [19], weist darauf hin, daß dieser Nucleus auch an menschlichen geschlechtlichen oder reproduktiven Funktionen beteiligt ist. Es ist vorgeschlagen worden, neurochemische Geschlechtsunterschiede im Ratten-BST auf den Einfluß von Geschlechtshormonen auf das Gehirn während Entwicklung und Erwachsenenalter [22,23] zurückzuführen. Unsere Daten von Menschen jedenfalls zeigen, daß die Größe des BSTc nicht von Änderungen von Hormonpegeln im Erwachsenenalter beeinflußt wird. Die Größe des BSTc einer 46-jährigen Frau, die für mindestens ein Jahr an einem Nebenierenrindentumor gelitten hatte, der sehr hohe Blutwerte an Androstenion und Testosteron produzierte, war im Rahmen des von anderen Frauen (Abb. 3: S1). Darüberhinaus zeigten zwei postmenopausale Frauen, beide über 70 Jahre, einen normalen BSTc von Frauengröße (Abb. 3: M1,M2). Da alle Transsexuelle mit Östrogenen behandelt worden waren, mochte die geringe Größe des BSTc möglicherweise auf hohe Östrogenpegel im Blut zurückzuführen sein. Offensichtlichkeit, die dagegen spricht, ergibt sich aus der Tatsache, daß die Transsexuellen T2 und T3 beide einen kleinen BSTc von Frauengröße (Abb. 3) haben, obwohl die Transsexuelle T2 fünfzehn Moante vor dem Tod die Einnahme von Östrogen stoppte, weil ihre Prolactinwerte zu hoch waren, und T3 die Hormontherapie stoppte, als ungefähr drei Monate vor ihrem Tod ein Sarkom gefunden worden war; auch hatte ein 31 Jahre alter Mann, der an einem feminisierenden Nebennierentumor litt, der mit sehr hohen Östrogenpegeln im Blut einherging, nichtsdestotrotz einen sehr großen BSTc (Abb. 3 : S2)
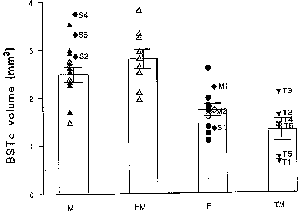 Figure 3: Volume of the BSTc innervated by VIP
fibres in presumed heterosexual males (M), homosexual males (HM), presumed
heterosexual females (F) and male-to-female transsexuals (TM). The six
transsexuals are numbered T1-T6. The patients with abnormal sex hormone
levels are numbered S1-S4. M1 and M2: postmenopausal women. Bars indicate
mean±SEM. Open symbols: individuals who died of AIDS. METHODS. Brains
of 42 subjects matched for age, postmortem time and duration of formalin
fixation were investigated. The autopsy was performed following the required
permission. For immunocytochemical staining of VIP, the paraffin sections
were hydrated and rinsed in TBS (Tris-buffered-saline: 0.05 M tris, 0.9%
NaCl, pH 7.6). The sections were incubated with 200 µl anti-VIP (Viper,
18/9/86) 1:1000 in 0.5% triton in TBS overnight at 4° C. The immunocytochemical
and morphometric procedures were performed as described extensively elsewhere
[25-27]. In brief, serial 6 m m sections of the BSTc were studied by means
of a digitizer (Calcomp 2000) connected to a HP-UX 9.0, using a Zeiss microscope
equipped with a 2.5x objective and with 10x (PLAN) oculars. Staining was
performed on every 50th section with anti-VIP. The rostral and caudal borders
of the BSTc were assessed by staining every 10th section in the area. The
volume of the BSTc was determined by integrating all the area measurements
of the BSTc sections that were innervated by VIP fibres. In a pilot study,
the size of the BSTc was measured on both sides in eight subjects (five
females and three males) and no left-right asymmetries were observed: the
left BSTc (1.71±0.16 mm3) was comparable in size to that
of the right BSTc (1.83±0.30 mm3) (P=0.79). No asymmetry
was observed in the BNST-dspm either [19]. The rest of our study was therefore
performed on one side of the brain only. Brain weight of the male transsexuals
(1385±75 g) was not different from that of the reference males (1453±25
g) (P=0.61) or that of the females (1256±35 g) (P=0.23). The cause
of death of the six transsexuals was suicide (T1), cardiovascular disease
(T2,T6), sarcoma (T3), AIDS, pneumonia, pericarditis (T4) and hepatitic
failure (T5). Sexual orientation of the subjects of the reference group
(12 men and 11 women) was generally not known, but presumably most of them
were heterosexual. Sexual orientation of nine homosexuals was registered
in the clinical records [28]. Differences among the groups were tested
two-tailed using the Mann-Whitney U test. A 5% level of significance was
used in all statistical tests.
Figure 3: Volume of the BSTc innervated by VIP
fibres in presumed heterosexual males (M), homosexual males (HM), presumed
heterosexual females (F) and male-to-female transsexuals (TM). The six
transsexuals are numbered T1-T6. The patients with abnormal sex hormone
levels are numbered S1-S4. M1 and M2: postmenopausal women. Bars indicate
mean±SEM. Open symbols: individuals who died of AIDS. METHODS. Brains
of 42 subjects matched for age, postmortem time and duration of formalin
fixation were investigated. The autopsy was performed following the required
permission. For immunocytochemical staining of VIP, the paraffin sections
were hydrated and rinsed in TBS (Tris-buffered-saline: 0.05 M tris, 0.9%
NaCl, pH 7.6). The sections were incubated with 200 µl anti-VIP (Viper,
18/9/86) 1:1000 in 0.5% triton in TBS overnight at 4° C. The immunocytochemical
and morphometric procedures were performed as described extensively elsewhere
[25-27]. In brief, serial 6 m m sections of the BSTc were studied by means
of a digitizer (Calcomp 2000) connected to a HP-UX 9.0, using a Zeiss microscope
equipped with a 2.5x objective and with 10x (PLAN) oculars. Staining was
performed on every 50th section with anti-VIP. The rostral and caudal borders
of the BSTc were assessed by staining every 10th section in the area. The
volume of the BSTc was determined by integrating all the area measurements
of the BSTc sections that were innervated by VIP fibres. In a pilot study,
the size of the BSTc was measured on both sides in eight subjects (five
females and three males) and no left-right asymmetries were observed: the
left BSTc (1.71±0.16 mm3) was comparable in size to that
of the right BSTc (1.83±0.30 mm3) (P=0.79). No asymmetry
was observed in the BNST-dspm either [19]. The rest of our study was therefore
performed on one side of the brain only. Brain weight of the male transsexuals
(1385±75 g) was not different from that of the reference males (1453±25
g) (P=0.61) or that of the females (1256±35 g) (P=0.23). The cause
of death of the six transsexuals was suicide (T1), cardiovascular disease
(T2,T6), sarcoma (T3), AIDS, pneumonia, pericarditis (T4) and hepatitic
failure (T5). Sexual orientation of the subjects of the reference group
(12 men and 11 women) was generally not known, but presumably most of them
were heterosexual. Sexual orientation of nine homosexuals was registered
in the clinical records [28]. Differences among the groups were tested
two-tailed using the Mann-Whitney U test. A 5% level of significance was
used in all statistical tests.
Unsere Ergebnisse könnten auch erklärbar sein,
wären die BSTc von Frauengöße in der Gruppe der Transsexuellen
auf das Fehlen von Androgenen zurückzuführen, denn alle außer
T4 waren ochidectomisiert. Daher studierten wir zwei andere Menschen, die
orchidectomisiert worden waren, dies wegen Prostatakrebs (einen und drei
Monate vor dem Tod, S4 und S3), und wir fanden heraus, daß die Größe
ihres BSTc am oberen Ende des männlichen Größenrahmens
lag. Die Größe des BSTc der Transsexuellen, die nicht orchidectomisiert
war (T4), rangierte in der Mitte der Transsexuellen-Ergebnisse. Nicht nur
waren fünf der Transsexuellen orchidectomisiert, alle hatten sie auch
Cyproteronacetat (CPA) eingenommen. Ein Einfluß von CPA auf die Größe
des BSTc scheint nicht wahrscheinlich, denn T6 hatte kein CPA in den letzten
zehn Jahren eingenommen, und T3 nahm kein CPA während der zwei Jahre
vor dem Tod, und hatten immer noch einen BSTc von Frauengröße.
Zusammenfassend legen unsere Beobachtungen nahe, daß
die geringe Größe des BSTc in MzF Transsexuellen nicht durch
Unterschiede von Hormonpegeln im Erwachsenenalter erklärt werden kann,
sondern daß sie sich während der Entwicklung durch eine organisierende
Aktion von Geschlechtshormonen etabliert, eine Vorstellung, die durch die
Tatsache unterstützt wird, daß vorgeburtliche Gonadectomien
von männlichen Ratten und Androgenisierungen von weiblichen Ratten
in der Tat signifikante Änderungen in der Zahl der Neuronen des BSTc
hervorriefen und den geschlechtlichen Dimorphismus [17,18] unterdrückten.
Zusammengenommen mit Informationen über Tiere unterstützt unsere Studie die Hypothese, daß Geschlechtsidentitätsalterationen sich als Ergebnis einer alterierten Wechselwirkung zwischen der Entwicklung des Gehirns und Geschlechtshormonen [5,6] entwickeln. Die direkte Wechselwirkung von genetischen Faktoren sollte ebenfalls auf Basis von Tierversuchen betrachtet werden [24].
Wir fanden keinen Zusammenhang zwischen der Größe des BSTc und der geschlechtlichen Ausrichtung von Transsexuellen, d.h. ob sie sich zu Männern (T1,T6), zu Frauen (T2,T3,T5) oder zu beiden (T4) hingezogen fühlten. Darüberhinaus unterschied sich die Größe des BSTc von heterosexuellen und homosexuellen Männern nicht, was die Vorstellung, daß die Größe des BSTc unabhängig von der geschlechtlichen Ausrichtung ist, verstärkte. Darüberhinaus gab es keinen Unterschied in Frühangriff-(T2,T5,T6) und Spätangriff- (T1,T3)Transsexuellen, was anzeigt, daß die geringe Größe des BSTc in Zusammenhang mit der Geschlechtsidentität per se steht und weniger mit dem Alter, an dem sie auftritt. Interessanterweise scheint die Größe des BSTc ein sehr örtlicher Gehirnunterschied zu sein. Es gelang uns nicht, ähnliche Änderungen in drei anderen hypothalamischen Nuclei, und zwar den PVN, SDN oder SCN in den gleichen Individuen zu beobachten (unveröffentlichte Daten). Das mag darauf zurückzuführen sein, daß diese nuclei sich nicht alle zur gleichen Zeit entwickeln, oder auf einen Unterschied zwischen diesen Nuclei und dem BST hinsichtlich des Vorhandenseins von Geschlechtshormonrezeptoren oder der Aromatase. Wir studieren nun die Verteilung von Geschlechtshormonrezeptoren und Aromataseaktivität in verschiedenen hypothalamsichen Regionen in Abhängigkeit von geschlechtlicher Ausrichtung und Geschlecht.
Danksagungen
Wir danken Mr. B. Fisser, Mr. H. Stoffels, Mr. G. van der Meulen, und Ms. T. Eikelboom und Ms. W.T.P. Verweij für ihre Hilfe, und Drs. R.M. Buijs, M.A. Corner, E. Fliers, A. Walter und F.W. van Leeuwen für ihre Kommentare. Gehirnmaterial wurde von der Netherlands Brain Bank (Koordinator Dr. R. Ravid) bereitgestellt. Diese Studie wurde unterstützt von der NWO.
References
Money, J. and Gaskin, Int. J. Psychiatry,
9 (1970/1971) 249.
Gooren, L.J.G., Psychoneuroencrinology, 15 (1990)
3-14.
Kawakami, M. and Kimura, F., Endocrinol. Jap.,
21 (1974) 125-130.
Emery, D.E. and Sachs, B.D., Physiol. Behav., 17
(1976) 803-806.
Editorials Lancet, 338 (1991) 603-604.
Swaab, D.F. and Hofman, M.A., TINS, 18 (1995) 264-270.
Money, J., Schwartz, M. and Lewis, V.G., Psychoneuroendocrinology,
9 (1984) 405- 414.
Sheridan, P.J., Endocrinology, 104 (1979) 130-136.
Commins, D. and Yahr, D., J. Comp. Neurol., 231
(1985) 473-489.
Jakab, R.L., Horvath, T.L., Leranth, C., Harada, N.
and Naftolin, F.J., Steroid Biochem. Molec. Biol., 44 (1993) 481-498.
Eiden, E.L., Hökfelt, T, Brownstein, M.J. and
Palkovits, M., Neuroscience, 15 (1985) 999-1013.
De Olmos, J.S. In: Paxinos, G. (Ed.), The Human
Nervous System, Academic Press, San Diego, 1990, pp. 597-710.
Woodhams, P.L., Roberts, G.W., Polak, J.M. and Crow,
T.J., Neuroscience, 8 (1983) 677-703.
Simerly, R.B., TINS, 13 (1990) 104-110.
Arluison, M., et al., Brain Res. Bull., 34 (1994)
319-337.
Bleier, R., Byne, W. and Siggelkow, I., J. Comp.
Neurol., 212 (1982) 118-130.
Del Abril, A., Segovia, S. and Guillamón, A.,
Dev. Brain Res., 32 (1987) 295-300.
Guillamón, A., Segovia, S. and Del Abril, A.,
Dev. Brain Res., 44 (1988) 281-290.
Allen, L.A. and Gorski, R.A., J. Comp. Neurol.,
302 (1990) 697-706.
Walter, A., Mai, J.K., Lanta, L. and Görcs, T.J.,
Chem. Neuroanat., 4 (1991) 281-298.
Claro, F., Segovia, S., Guilamón, A. and Del
Abril, A., Brain Res. Bull., 36 (1995) 1-10.
Simerly, R.B. and Swanson, L.W., Proc. Natl. Acad.
Sci. U.S.A., 84 (1987) 2087- 2091.
De Vries, G.J., J. Neuroendocrinol., 20 (1990)
1-13.
Pilgrim, Ch. and Reisert, I., Horm. metab. Res.,
24 (1992) 353-359.
Swaab, D.F., Zhou, J.N., Ehlhart, T. and Hofman, M.A.,
Brain Res., 79 (1994) 249- 259.
Zhou, J.N., Hofman, M.A. and Swaab, D.F., Neurobiol.
Aging (1995) in press.
Zhou, J.N., Hofman, M.A.
and Swaab, D.F.,
Brain Res. 672 (1995) 285-288.
Swaab D.F. and Hofman M.A., Brain Res., 537 (1990)
141-148.
Correspondence and requests for materials to:
J.-N. Zhou, M.A. Hofman and D.F. Swaab
Graduate School Neurosciences Amsterdam
Netherlands Institute for Brain Research
Meibergdreef 33
1105 AZ Amsterdam ZO
The Netherlands
L.J.G. Gooren
Department of Endocrinology
Free University Hospital
1007 MB Amsterdam
The Netherlands
Email: lgooren@inter.nl.net
Übersetzung ohne Gewähr